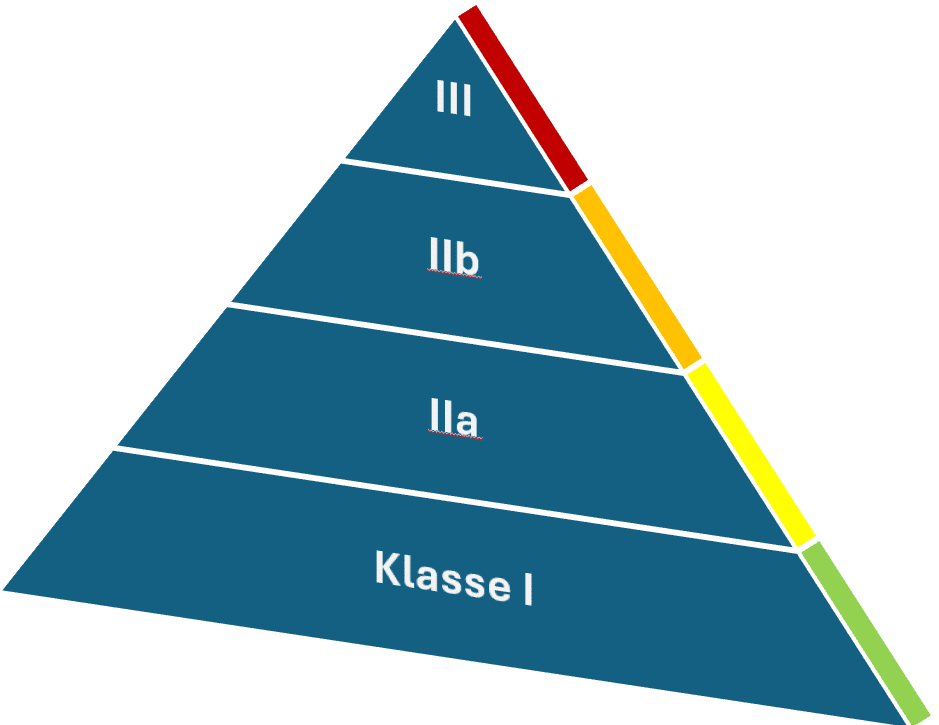
Die unterschiedlichen Klassen
Medizinprodukte und Zubehör werden in der Europäischen Union gemäß der MDR, also genauer gesagt gemäß Anhang VIII der Verordnung (EU) 2017/745 eingestuft. Die Klassifizierung basiert auf 22 Regeln sowie relevanten Definitionen und Durchführungsvorschriften. Die zugrundeliegende Idee besteht darin, Medizinprodukte anhand ihres Risikos zu unterscheiden. Je höher das Risiko, desto höher ist die Risikoklasse. Folgende Klassen sind definiert:
- Klasse I (niedriges Risiko)
- Klasse IIa (niedriges bis mittleres Risiko)
- Klasse IIb (mittleres bis hohes Risiko)
- Klasse III (hohes Risiko)
In der Praxis werden zudem folgende Klassen unterschieden:
- Klasse Ir (wiederverwendbare chirurgische Instrumente der Klasse I)
- Klasse Is (sterile Produkte der Klasse I)
- Klasse Im (Produkte der Klasse I mit Messfunktion)
Diese Klassen sind in dieser Form in der MDR nicht definiert. Bei Produkten, die in sterilem Zustand in den Verkehr gebracht werden, bei Produkten mit Messfunktion oder bei Produkten, bei denen es sich um wiederverwendbare chirurgische Instrumente handelt, muss der Hersteller die in MDR Anhang IX Kapitel I und III oder in Anhang XI Teil A aufgeführten Verfahren anwenden. Das bedeutet, dass eine benannte Stelle zur Konformitätsbewertung benötigt wird. Aus diesem Grund wird für Produkte der Klasse I, die sonst keine benannte Stelle brauchen, eine zusätzliche Unterteilung in Ir, Is und Im gemacht.
Grundlagen zur Klassifizierung
Die Anwendung der in Anhang VIII beschriebenen 22 Regeln zur Bestimmung der Klassen für Medizinprodukte erfordern ein genaues Wissen über die geltenden Definitionen aus folgenden Quellen:
- Artikel 2 Begriffsbestimmungen
- Anhang VIII Kapitel I
Zusätzlich müssen die Durchführungsvorschriften aus Anhang VIII Kapitel II beachtet werden.
Mit diesen Grundlagen wird die Zweckbestimmung des Medizinprodukts oder eines Zubehörs analysiert, um festzustellen, welche der 22 Regeln anwendbar sind und in welche Klassen Medizinprodukte oder Zubehör demnach einzustufen sind. Für dieses Vorgehen ist es zwingend erforderlich, dass die Zweckbestimmung vorliegt und äußerst gewissenhaft gearbeitet wird. Fehlerhafte Klassifizierungen können in höheren Risikoklassen und somit in teilweise immens höheren Kosten resultieren. Dies gilt es daher zu vermeiden!
Definitionen
Anhang VIII beschreibt Definitionen, die zusätzlich zu den Begriffsbestimmungen in Artikel 2 relevant sind. Diese hätten auch in Artikel 2 aufgenommen werden können, sind aber letztendlich nur für die Klassifizierung relevant und wurden daher vermutlich in Anhang VIII aufgenommen. Die Definitionen unterteilen sich in zwei Kategorien. Um an dieser Stelle nicht 1:1 den Inhalt der Verordnung widerzugeben und stattdessen einen informativen Mehrwert für Sie zu schaffen, stellen wir lediglich einen kurzen Auszug dar. Sollten Sie die genauen Definitionen benötigen, verlinken wir Ihnen die MDR weiter unten im Beitrag.
- Dauer der Anwendung
- „Vorübergehend“ bedeutet unter normalen Bedingungen für eine ununterbrochene Anwendung über einen Zeitraum von weniger als 60 Minuten bestimmt.
- „Kurzzeitig“ bedeutet unter normalen Bedingungen für eine ununterbrochene Anwendung über einen Zeitraum zwischen 60 Minuten und 30 Tagen bestimmt.
- „Langzeitig“ bedeutet unter normalen Bedingungen für eine ununterbrochene Anwendung über einen Zeitraum von mehr als 30 Tagen bestimmt.
- Invasive und aktive Produkte
- „Körperöffnung“ bezeichnet eine natürliche Öffnung des Körpers sowie die Außenfläche des Augapfels oder eine operativ hergestellte ständige Öffnung, wie z.B. ein Stoma.
- Chirurgisch-invasives Produkt“ […]
- „Wiederverwendbares chirurgisches Instrument“ […]
- „Aktives therapeutisches Produkt“ […]
- „Aktives Medizinprodukt zu Diagnose- und Überwachungszwecken“ […]
- „Zentrales Kreislaufsystem“ […]
- „Zentrales Nervensystem“ […]
- „Verletzte Haut oder Schleimhaut“ […]
Viele der Klassifizierungsregeln beziehen sich auf diese Definitionen. Sie sollten daher jene kennen, die für Ihr Produkt relevant sind. Wir haben beobachtet, dass teilweise schon die Einstufung als invasives oder aktives Produkt gemäß der Definition in Artikel 2 fehlerhaft ist und dadurch die Definitionen aus Anhang VIII ebenfalls falsch angewendet werden.
Sehen wir uns folgendes Beispiel an:
„invasives Produkt“ bezeichnet ein Produkt, das durch die Körperoberfläche oder über eine Körperöffnung ganz oder teilweise in den Körper eindringt [Quelle: MDR, Artikel 2]
Körperöffnung ist in Artikel 2 nicht definiert und wird daher bei der initialen Betrachtung oft anders interpretiert, als es die Definition in Anhang VIII vorsieht. Sie finden diese etwas weitere oben in der Aufzählung. Wenn ein Produkt fälschlicherweise als invasives Produkt eingestuft wird, resultiert das schnell in einer Risikoklasse ab IIa, wohingegen ein nicht invasives Produkt in vielen Fällen in Klasse I eingestuft wird. Es wird zudem deutlich, dass man die Definitionen aus beiden Fundstellen der MDR kennen sollte.
Durchführungsvorschriften
Es gibt aktuell 7 Durchführungsvorschriften, die in Anhang VIII der MDR genannt werden. Inhaltlich sind dies:
- Klassifizierung gemäß Zweckbestimmung
- Klassifizierung von verbundenen Produkten und Zubehör
- Klassifizierung von Software
- Klassifizierung von Produkten, die an unterschiedlichen Körperstellen angewendet werden
- Klassifizierung, wenn mehrere Regeln anwendbar sind
- Ermittlung der Anwendungsdauer
- Klassifizierung von Produkten, die eine direkte Diagnose ermöglichen
Den genauen Wortlaut je Durchführungsvorschrift können Sie der MDR entnehmen. Wir haben diese weiter unten im Beitrag für Sie referenziert.
Wir beobachten eine Häufung bei Herstellern der Klasse I hinsichtlich der fünften Durchführungsvorschrift. In diesen Fällen werden nicht sämtliche anwendbare Regeln berücksichtigt, sondern meist die erste anwendbare Regel genutzt, um die Klasse des Medizinprodukts zu bestimmen. Wenn mehrere Regeln anwendbar sind, ist die letztendliche Klasse allerdings die höchste Klasse aller anwendbaren Regeln. Bei Herstellern, die bereits Medizinprodukte der Klasse IIa bis III im Portfolio haben, ist dieser Umstand allerdings weitestgehend bekannt.
Klassifizierungsregeln
Die 22 Regeln werden in vier Kategorien unterteilt:
- Nicht invasive Produkte (Regeln 1 bis 4)
- Invasive Produkte (Regeln 5 bis 8)
- Aktive Produkte (Regeln 9 bis 13)
- Besondere Regeln (Regeln 14 bis 22)
Wenn das zu klassifizierende Produkt ein nicht invasives Produkt ist, sind die Regeln 5 bis 8 für invasive Produkte nicht näher relevant. Trotzdem müssen Sie die Regeln 6 bis 22 auf Anwendbarkeit prüfen, da die fünfte Durchführungsvorschrift besagt, dass die höchste Klassifizierung zutreffend ist, wenn mehrere Regeln anwendbar sind. Im Umkehrschluss bedeutet das, Sie müssen überprüfen, ob mehrere Regeln anwendbar sind.
Wichtig ist außerdem, dass Sie diesen Vorgang angemessen dokumentieren, damit eine benannte Stelle oder Aufsichtsbehörde die Klassifizierung anhand Ihrer Argumentation überprüfen kann. Gemäß Anhang II der MDR sind diese Aufzeichnungen in die technische Dokumentation aufzunehmen. Im Wortlaut wird darin gefordert:
f) die Risikoklasse des Produkts und die Begründung für die gemäß Anhang VIII angewandte(n) Klassifizierungsregel(n);
Die Begründung für die angewandten Regeln basiert wesentlich auf dem Ausschlussverfahren – Also der Begründung dafür, dass gewisse Regeln nicht anwendbar sind. Zudem sollte nachvollziehbar sein, warum welche der geltenden Definitionen das jeweilige Produkt beschreiben. In einigen Fällen ist es ratsam zu dokumentieren, warum bestimmte Definitionen nicht zutreffen.
Beispiel zur Klassifizierung
Um Ihnen anhand eines einfachen Beispiels die Klassifizierung zu erklären, betrachten wir ein Produkt das jeder Kennt: Ein schlichtes Pflaster. Nehmen wir dafür folgende Zweckbestimmung an:
Das thinqbetter Pflaster KLASSIK ist ein textiler Wundschnellverband zur hygienischen Wundversorgung von kleineren, oberflächlichen Verletzungen der Haut. Es deckt die Wunde ab, um sie vor Verschmutzung zu schützen und verklebt nicht mit dieser. Die Anwendung darf bis zu einer Dauer von 14 Tagen erfolgen, da langsamer heilende Wunden von einem Facharzt behandelt werden sollten.
Folgende Überlegungen zu Definitionen aus Artikel 2 helfen nun:
- „aktives Produkt“ ist nicht zutreffend;
- „implantierbares Produkt“ ist nicht zutreffend;
- „invasives Produkt“ ist nicht zutreffend;
Wir erkennen nun, dass die Regeln für invasive Produkte (5 bis 8) sowie für aktive Produkte (9 bis 13) nicht anwendbar sein können. Es bleiben somit die Regeln für nicht invasive Produkte (1 bis 4) und die besonderen Regeln (14 bis 22) zur Überprüfung.
Allerdings sollten wir zunächst einen Blick in die Definitionen des Anhangs VIII werfen:
- „Vorübergehend“ ist nicht anwendbar, da es eine Dauer der Verwendung von weniger als 60 Minuten beschreibt;
- „Kurzzeitig“ ist anwendbar. Diese Definition erlaubt eine Anwendung zwischen 60 Minuten und 30 Tagen.
- „Langzeitig“ ist nicht anwendbar.
Weitere Definitionen beziehen sich auf invasive und aktive Produkte und sind damit nicht näher zu betrachten.
Zusätzlich zur Zweckbestimmung behalten wir also im Kopf, dass das Produkt nicht invasiv ist und vorübergehend angewendet wird.
Regel 1
Alle nicht invasiven Produkte gehören zur Klasse I, es sei denn, es findet eine der folgenden Regeln Anwendung.
Diese Regel ist auf ein vorübergehend angewendetes nicht invasives Produkt anwendbar.
Das Medizinprodukt wird gemäß Regel 1 in Klasse I eingestuft.
Regel 2
Alle nicht invasiven Produkte für die Durchleitung oder Aufbewahrung von Blut, anderen Körperflüssigkeiten, -zellen oder -geweben, Flüssigkeiten oder Gasen zum Zwecke einer Infusion, Verabreichung oder Einleitung in den Körper gehören zur Klasse IIa,
- wenn sie mit einem aktiven Produkt der Klasse IIa, der Klasse IIb oder der Klasse III verbunden werden können oder
- wenn sie für die Durchleitung oder Aufbewahrung von Blut oder anderen Körperflüssigkeiten oder für die Aufbewahrung von Organen, Organteilen oder Körperzellen und -geweben eingesetzt werden, mit Ausnahme von Blutbeuteln; Blutbeutel gehören zur Klasse IIb.
In allen anderen Fällen gehören solche Produkte zur Klasse I.
Das Pflaster ist nicht für die Durchleitung oder Aufbewahrung von Blut, anderen Körperflüssigkeiten, -zellen oder -geweben, Flüssigkeiten oder Gasen zum Zwecke einer Infusion, Verabreichung oder Einleitung in den Körper vorgesehen. Die Regel ist daher nicht anwendbar.
Regel 3
Alle nicht invasiven Produkte zur Veränderung der biologischen oder chemischen Zusammensetzung von menschlichen Geweben oder Zellen, Blut, anderen Körperflüssigkeiten oder Flüssigkeiten, die zur Implantation oder Verabreichung in den Körper bestimmt sind, gehören zur Klasse IIb, es sei denn, die Behandlung, für die das Produkt verwendet wird, besteht aus einer Filtration, Zentrifugierung oder dem Austausch von Gas oder Wärme. In diesem Fall werden sie der Klasse IIa zugeordnet.
Alle nicht invasiven Produkte, die aus einem Stoff oder einer Mischung von Stoffen bestehen, die für den In-vitro-Gebrauch in unmittelbarem Kontakt mit dem menschlichen Körper entnommenen menschlichen Zellen, Geweben oder Organen oder für den In-vitro-Gebrauch mit menschlichen Embryonen vor deren Implantation oder Verabreichung in den Körper bestimmt sind, werden der Klasse III zugeordnet.
Das Pflaster wird grundsätzlich nicht im Rahmen oder in Verbindung mit einer Implantation oder Verabreichung von etwas in den Körper angewendet. Der erste Teil der Regel ist daher offensichtlich nicht anwendbar. Da das Pflaster auch nicht im Rahmen eines In-vitro-Gebrauchs verwendet wird, ist der zweite Teil nicht näher zu prüfen und nicht anwendbar.
Regel 4
Alle nicht invasiven Produkte, die mit verletzter Haut oder Schleimhaut in Berührung kommen,
- werden der Klasse I zugeordnet, wenn sie als mechanische Barriere oder zur Kompression oder zur Resorption von Exsudaten eingesetzt werden,
- werden der Klasse IIb zugeordnet, wenn sie vorwiegend bei Hautverletzungen eingesetzt werden, bei denen die Dermis oder die Schleimhaut durchtrennt wurde und die nur durch sekundäre Wundheilung geheilt werden können,
- werden der Klasse IIa zugeordnet, wenn sie vorwiegend zur Beeinflussung der Mikroumgebung verletzter Haut oder Schleimhaut bestimmt sind, und
- werden in allen anderen Fällen der Klasse IIa zugeordnet.
Diese Regel gilt auch für die invasiven Produkte, die mit verletzter Schleimhaut in Berührung kommen.
Das Pflaster kommt als Wundschnellverband mit verletzter Haut in Berührung. Regel 4 ist somit anwendbar. Jetzt ist näher zu prüfen, welche Klasse für das Medizinprodukt aus Regel 4 resultiert. Dafür werden die Unterpunkte der Regel überprüft.
Teil 1 ist anwendbar, da ein Wundschnellverband als mechanische Barriere eingesetzt wird.
Teil 2 ist nicht anwendbar. Wunden für die ein Wundschnellverband geeignet ist, sind kleinere, oberflächliche Wunden, die üblicherweise binnen weniger Tage abheilen. Bei solchen Wunden liegt kein nennenswerter Gewebeverlust vor und die Wundheilung verläuft im Rahmen der sogenannten primären Wundheilung. Großflächige, tiefe Abschürfungen heilen über die sekundäre Wundheilung. Hier entsteht Granulationsgewebe und die Wunde heilt nicht von den Wundrändern aus zu, sondern flächig. Zudem entsteht hier eine signifikante Narbenbildung.
Teil 3 ist nicht anwendbar, da das Pflaster nicht zur Beeinflussung der Mikroumgebung der Wunde genutzt wird.
Teil 4 ist nicht anwendbar, da Teil 1 anwendbar ist.
Das Medizinprodukt wird gemäß Regel 4 in Klasse I eingestuft.
Regel 14 bis 22
Um den Beitrag übersichtlich zu halten, gehen wir auf die Regeln 14 bis 22 nicht ein. Sie sind nicht anwendbar. In den oben gezeigten kurzen Betrachtungen erkennen Sie, wie im Rahmen der Bestimmung der Klasse für Medizinprodukte vorgegangen wird. Um eine Aufzeichnung für die technische Dokumentation zu erstellen, werden diese Betrachtungen detailliert dokumentiert – einschließlich der Regeln 14 bis 22 natürlich.
Klasse des Medizinprodukts
Im aktuellen Fall sind die Regeln 1 und 4 anwendbar. Beide Regeln zeigen, dass das Medizinprodukt in Klasse I eingestuft wird. Sollte eine der Regeln allerdings eine höhere Klasse fordern, so wäre diese höhere Klasse die, die dem Produkt zugewiesen werden muss.
Das thinqbetter Pflaster KLASSIK ist ein Medizinprodukt der Klasse I.
Fundstelle MDR
Die Medizinprodukteverordnung (EU) 2017/745 können Sie hier herunterladen. Achten Sie darauf, die aktuelle Version zu beziehen, da hin und wieder Korrekturen sowie konsolidierte Versionen hochgeladen werden.
